
Comment et pour quelles raisons les atomes forment des ions?
Quand on lit une étiquette de bouteille d'eau minérale (chacun ses goûts en littérature), on y trouve souvent ce genre d'information:
C'est pour ça qu'on l'achète, on veut une eau riche en "sels minéraux", donc en substances dissoutes. Et ce ne sont pas des atomes gentiment neutres comme tous les atomes bien élevés, mais des ions comme Ca2+ et F-. Et pourquoi pas Ca3+ ou F2- d'ailleurs? Pourquoi pas simplenent des atomes?...
| Les bases à connaître | |||
| Un atome est constitué d'un noyau, autour de celui-ci, il y a des électrons | |||
| Les électrons se disposent en couches et sous couches | |||
|
|||
Voici dans quel ordre les couches se remplissent:

Un peu étrange, d'accord, mais finalement, quand on regarde le tableau périodique, on constate que sa structure reproduit cet ordre de remplissage:
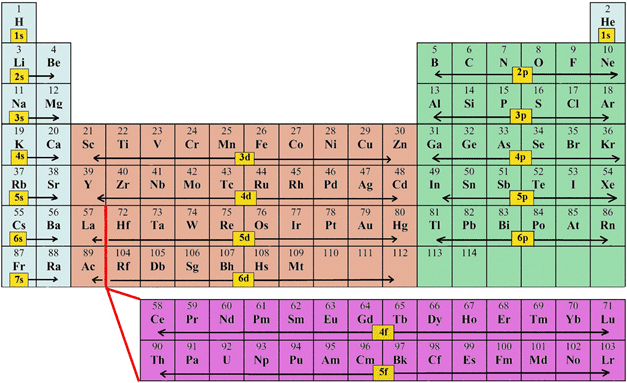
Finalement, faisons simple: la dernière colonne contient des atomes avec leurs sous-couches pleines. Ce sont les atomes les plus stables, les gaz rares. Tous les autres atomes tentent de leur ressembler en volant ou perdant des électrons (ils donnent alors des ions), ou alors, en faisant des mises en commun d'électrons avec d'autres atomes, et donc en faisant des associations entre atomes: des molécules. Mais parlons ici des ions.
Exemple 1: Le Chlore (Cl) contient 17 électrons en tout (17ème case du tableau):
Sa strucure électronique est 1s2 2s2-2p6 3s2-3p5, ou plus simplement ici, K2 L8 M7 (ou encore avant dernière colonne du tableau...)
Il a très envie de ressembler à un gaz rare (qui sont les éléments de la dernière colonne) et ainsi avoir une dernière couche pleine. Alors, à la première occasion qui va se présenter, il va "voler" un électron a un autre atome. Il devient donc négatif, on va l'écrire Cl-. Et comme il n'a aucune raison de gagner 2 électrons, il ne deviendra pas Cl2-...
Mais encore faut-il trouver un atome qui veuille bien se laisser voler tranquillement un électron. Justement, ça existe...
Exemple 2: Le Sodium (Na) contient 11 électrons en tout:
Sa strucure électronique est 1s2 2s1, ou plus utile ici, K2 L1 (ou encore 1ère colonne du tableau...)
Lui aussi ne rêve que d'une chose, ressembler à un gaz rare et d'avoir sa dernière couche pleine. Alors, il va débarrasser de son électron de dernière couche. Il devient donc positif (puisqu'un électron est négatif, et qu'il s'en sépare), on va alors l'écrire Na+. Et comme il n'a aucune raison de perdre 2 électrons, il ne deviendra pas Na2+...
Vous vous doutez que les ions Chlorures Cl- et Sodium Na+ sont faits pour s'entendre: à eux deux, ils forme la solution la plus abondante sur Terre, l'eau salée des océans.
Exemple 3: Le Magnésium (Mg) contient 12 électrons au total:
Sa strucure électronique est 1s2 2s2-2p6 3s2, ou plus utile ici, K2 L8 M2 (ou 2ème colonne du tableau...)
Vous avez compris le truc, il voudrait bien perdre ses deux électrons de dernière couche, pour qu'il ne lui reste la précédente, pleine: il devient donc Mg2+
En résumé, les atomes, quand ils le peuvent, cherchent à gagner en stabilité en s'approchant de la structure électronique des gaz rares, en perdant ou gagnant des électrons. Mais pas n'importe quelle quantité, celle qui est définie par l'emplacement de l'atome dans le tableau...