
Comment et pour quelles raisons les atomes forment des molécules?
C'est vrai ça... Pourquoi les atomes ne resteraient-ils pas simplement dans leur coin? Alors que très souvent, ils s'accrochent entre eux pour former des molécules. Il doit bien y avoir des raions. Voyons ça...
| Les bases à connaître | |||
| Un atome est constitué d'un noyau, autour de celui-ci, il y a des électrons | |||
| Les électrons se disposent en couches et sous couches | |||
|
|||
Voici dans quel ordre les couches se remplissent:

Un peu tordu, d'accord, mais finalement, quand on regarde le tableau périodique, on constate que sa structure reproduit cet ordre de remplissage:
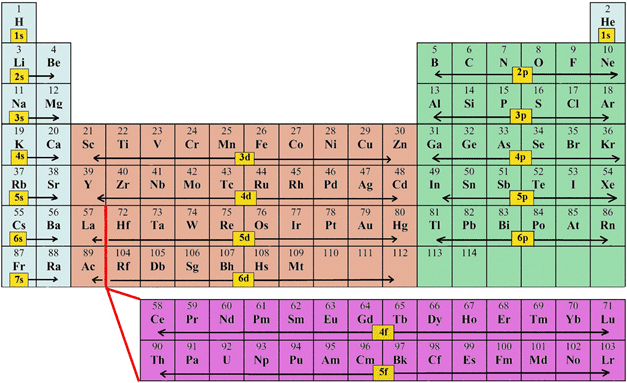
Finalement, faisons simple: la dernière colonne contient des atomes avec leurs sous-couches pleines. Ce sont les atomes les plus stables, les gaz rares. Tous les autres atomes tentent de leur ressembler en volant ou perdant des électrons (ils donnent alors des ions), ou alors, en faisant des mises en commun d'électrons avec d'autres atomes. Et c'est justement cette dernière méthode qui conduit aux molécules.
Exemple 1: L'Hydrogène ne contient qu'un seul électron
Sa strucure électronique est 1s1, ou plus utile ici, K1 (ou 1ère colonne du tableau...)
Exemple 2: Le Carbone contient 6 électrons en tout, mais seule la couche externe nous intéresse pour la formation des molécules.
Sa strucure électronique est 1s2 2s2-2p2, ou plus utile ici, K2 L4 (ou 4ème colonne du tableau...)
Exemple 3: L'Oxygène contient 8 électrons en tout, mais regardons sa couche externe
Sa strucure électronique est 1s2 2s2-2p4, ou plus utile ici, K2 L6 (ou 6ème colonne du tableau...)
Efficace cette théorie de la mise en commun des électrons: elle permet de prédire pas mal de choses sur les formules et les géométries des molécules. Théorie simple, grosses prédictions, que voulez-vous de mieux?...