
Combien de gouttes d'eau peuvent tenir sur une pièce de un centime?
Voilà enfin une vraie question existentielle. "Comment lutter contre le réchauffement climatique?" "Comment contribuer à la stabilité du Moyen-Orient?"... Ces questions font bien pâle figure à côté de celle qui est posée ici...
Tout d'abord, par simple curiosité, essayons. Une pièce de 1 centime (enfin une utilisation possible de cet objet...) une pipette, de l'eau et beaucoup de délicatesse. Versez vos gouttes une à une sur la pièce... Et c'est plutôt à la fois étonnant et joli!
Et en plus, on peut en verser plein, plus d'une vingtaine si vous êtes moyennement doué. Ca donne ceci, un peu avant de tremper la table:

Ou cela, en vue de côté:

Ca ressemble plus à un "sac d'eau" qu'à une pièce mouillée. Et on ne croit pas si bien dire d'ailleurs. En effet, les métaux sont plutôt mouillables d'habitude, c'est à dire qu'une goutte déposée à sa surface s'y étale facilement. Mais ici, la pièce n'est pas très lisse, ni exempt d'oxydes, ce qui empêche l'étalement des gouttes, l'eau préfère rester en boule. C'est aussi ce qui explique que les canards ne sont jamais mouillés ou que les gouttes d'eau sont rondes...
Pourquoi un "sac" d'eau? Parce que l'eau libre est vraiment recouverte d'une "peau" naturelle: les molécules d'eau elles-mêmes s'en chargent car elles sont polarisées, elles ont toutes un côté positif et un côté négatif. Ainsi, un côté positif d'une molécule attire le côté négatif d'une autre. Les molécules d'eau font ainsi preuve d'une grande cohésion:
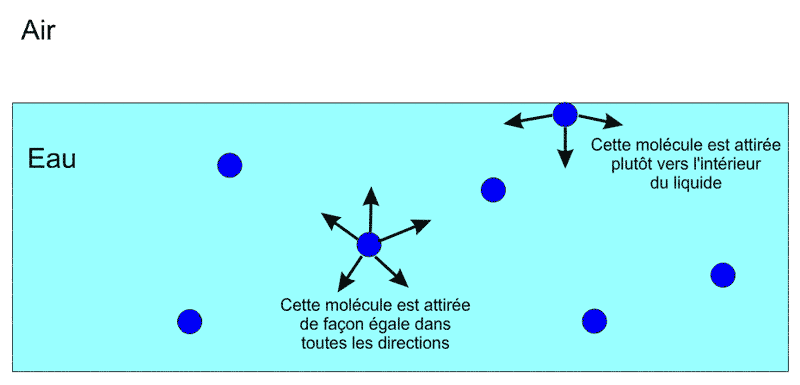
Celles qui sont au sein du liquide sont attirées dans toutes les directions de la même façon, mais pas celles de la surface. Pour elles, l'attraction vers l'intérieur du liquide domine. Si on lui en laisse la liberté, l'eau se met en boule. La gravité empêche souvent ça. L'eau renversée d'un verre ne se met pas en boule, mais en impesanteur, il en va tout autrement.

Donc, notre tas d'eau se maintient à la surface de la pièce, jusqu'à ce que la gravité fissure la "peau" de la goutte et qu'elle se répande sur la table. Peut-on déchirer la peau autrement? Avec un couteau par exemple? Et bien ça ne fonctionne pas, sauf si la pointe du couteau est enduite d'une substance magique: du savon.
Observez ces deux images alternées: pour l'une le sac d'eau est en contact d'une lame de couteau propre. Pour l'autre, un peu de savon en couvre la pointe. Voyez-vous comme le sac s'avachit lors du contact avec le savon?

Il suffit que la pièce supporte quelques gouttes de plus, et la lame savonnée peut crever la "peau du sac d'eau"...
Que s'est-il passé? Le savon est constitué de molécules tensio-actives, qui se combinent facilement aux molécules d'eau, qui s'attirent alors beaucoup moins entre elles: En étant technique, on dit qu'on a abaissé la tension superficielle du liquide, on lui donne maintenant plus de facilité pour mouiller la surface et s'étaler.
Vous devinez de nombreuses possibilités de jeu: changer de matériau de support, de liquide (mais attention, la taille des gouttes dépend du liquide justement...), essayez avec une pièce bien propre ou enduite de savon, ou légèrement graissée (tiens... les canards graissent leurs plumes pour qu'elles restent hydrophobes, et qu'ils ne se mouillent pas!...)
Et sachez que ce n'est pas qu'un jeu: les traitements des surfaces (dépôts de peintures, salissures des vitres, gouttes de produits phytosanitaires sur les plantes...) jouent un rôle considérable dans les domaines scientifiques et industriels.
Voilà de quoi s'occuper sainement pour nous distraire quelques temps des graves questions sociétales et politiques...