 |
 |
| Un cristal de graphite (1 mm)... | Et un autre de diamant (3 mm). |
Les différences entre ces deux frères sont spectaculaires:
Graphite, diamant, tout ça c'est du carbone... Alors pourquoi ces différences?
Et oui, c'est ce que dit la chimie: formule du graphite: C et formule du diamant: C aussi
 |
 |
| Un cristal de graphite (1 mm)... | Et un autre de diamant (3 mm). |
Les différences entre ces deux frères sont spectaculaires:
| Graphite | Diamant |
| Matériau très mou | Matériau très dur |
| Conducteur de courant | Isolant électrique |
| Conduit moyennement la chaleur | Excellent conducteur de chaleur |
| Opaque à la lumière visible | Transparent à la lumière visible |
Mais comment expliquer toutes ces différences, alors même qu'ils sont composés d'exactement des mêmes atomes? La raison tient à la façon dont sont arrangés ces atomes les uns par rapport aux autres. Et là, vous verrez que ces structures sont bien distinctes.
| Graphite | Diamant |
 |
 |
| Les atomes de carbone forment des grilles à mailles hexagonales, séparées les unes des autres, comme des feuilles d'un livre | Et là, chaque atome est fermement lié à 4 voisins proches. L'ensemble ne forme qu'un seul bloc |
Ces structures permettent déjà de comprendre la différence de dureté. Si vous passez votre doigts sur du graphite, vous sentez une douceur grasse, due au glissement des feuillets de carbone les uns par rapport aux autres. Ils se détachent facilement. Quand vous écrivez avec votre crayon "à papier" (ou "crayon gris"), vous laissez sur votre feuille une traînée de minuscules plaquettes de graphite... Le diamant a par contre une structure très rigide. Les atomes ne sont pas bien gros, mais ils forment le réseau le plus dense du règne minéral. Attention, "dur" ne veut pas dire "solide", un diamant peut être très cassant selon certains plans privilégiés. Ne tapez pas à coup de marteau sur votre bague de fiançailles dans le seul but de démontrer pédagogiquement sa "dureté", vous pourriez être déçu...
En ce qui concerne la conduction électrique, il faut se souvenir qu'un courant est un déplacement d'électrons. Ce sont aussi eux qui servent de "colle" entre atomes (les liaisons...). Or, un atome de carbone peut faire 4 liaisons, elles sont donc toutes utilisées dans le cas du diamant, il n'y a plus d'électron disponible pour transporter du courant, c'est un très bon isolant. Mais chaque atome du graphite ne se lie qu'à 3 confrères, des électrons se trouvent donc en mesure de se déplacer le long du réseau cristallin.
Pour la conduction thermique, c'est un peu plus compliqué. Pour les métaux (conducteurs électriques), c'est essentiellement les électrons qui se chargent une fois encore du transport de la chaleur dans la matière. Dans une moindre mesure, les oscillations des atomes du réseau, qui se propagent de proche en proche y contribuent également. Le graphite étant conducteur, il est alors compréhensible qu'il conduise également la chaleur. Le diamant, lui est isolant électrique, pourtant, il conduit encore mieux la chaleur que le cuivre ou l'argent! On pourrait imaginer d'excellentes casseroles en diamant, mais je perçois certaines difficultés pratiques et financières... Si sa conduction thermique est si forte, il faut en imputer la responsabilité à la propagation des oscillations d'atomes: en effet, le réseau est si rigide et les atomes si proches, que l'efficacité du transport d'énergie en est étonnante! Ainsi, les bijoutiers peuvent reconnaître un diamant en posant leurs lèvres à sa surface: ils perçoivent alors une sensation de froid typique des bons conducteurs thermiques (comme les métaux)
Le graphite est opaque, c'est un cas fréquent chez les conducteurs. En effet, les grains de lumière (photons) en interagissant avec le cristal communiquent leur énergie aux électrons de conduction. Et donc, ils ne survivent pas à leur traversée du milieu. Le diamant ne possède pas de tels électrons de conduction, et les vibrations des liaisons C-C ne correspondent à aucune énergie de rayonnement visible. Ainsi, la lumière traverse aisément le cristal. De plus, l'indice de réfraction du diamant est tellement élevé, que la lumière peut subir de nombreuses réflexions totales internes (si le joaillier lui a donné une forme adaptée), qui vont lui conférer tout son éclat, qui n'a rien à voir avec celui d'un morceau de verre taillé par exemple.
Pour finir, jetons un oeil pas trop distrait sur ce diagramme. Il a un aspect pas très rigolo, mais il permet de comprendre 2 ou 3 petites choses curieuses:
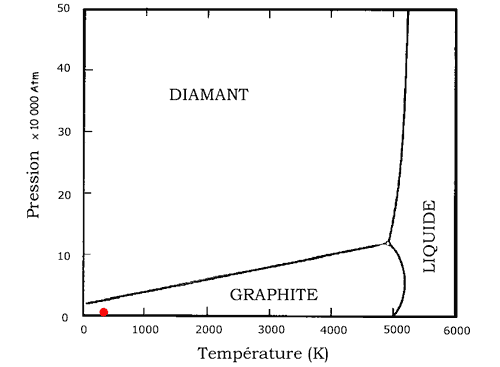
| C'est ce que l'on appelle un diagramme des phases, vous pouvez voir celui de l'eau aussi si vous voulez. Ce graphique est en fait très simple à lire. Par exemple, il nous dit qu'à la température ambiante (environ 300 K ou 27°C), et à la pression normale (1 atmosphère), seul le graphite est stable (nous sommes au point rouge du schéma). Traduction: le diamant est instable! Ce qui veut dire qu'il pourrait se transformer spontanément en graphite... Imaginons avec délectation la tête des riches propriétaires se retrouvant avec un collier de charbons autour du cou... En fait, le diamant est dans un état métastable, c'est à dire qu'il peut conserver son aspect pendant des durées géologiques. Mais il ne faut pas trop le pousser quand même. |  |
Le même diagramme indique aussi que l'on peut transformer du graphite en diamant... Il suffit de le comprimer très fortement (on monte le long du graphique depuis le point rouge), à l'aide d'enclumes... en diamant justement. C'est comme cela que sont fabriqués les diamants industriels servant d'abrasifs par exemple. Ne vous attendez pas à fabriquer par ce moyen de belles pièces utilisables en bijouterie.
Ah oui, j'oubliais, le carbone, ça brûle... Les diamants aussi, comme l'a montré Jean Darcet au XVIIIème siècle. Imaginez le comble du snobisme, plutôt que de brûler un billet de banque, faire des grillades avec des diamants comme combustible.
Alors vous voyez, au prix où on les paye, c'est fragile comme tout, alors il faut bien les assurer contre les risques ... naturels...
Une dernière petite chose (c'est comme les cacahouètes salées: quand on a commencé, c'est dur de s'arrêter...). La carbone existe dans la nature sous d'autres formes. Dans la suie des chandelles par exemple, on peut trouver des "fullerènes", dont les molécules ont des formes de ballons de football. On sait aussi fabriquer des nanotubes.
 |
 |
| Une molécule de fullerène (C60)... | Un morceau de nanotube. |
Et même, depuis peu, on arrive à générer des nanotubes contenant des fullerènes! Pour l'instant, bien peu nombreux sont ceux qui peuvent déjà imaginer des utilisations réalistes à ces minuscules édifices. On parle de boîtes à molécules, ou de stockage d'hydrogène... L'avenir risque d'être encore plus surprenant.
 |
| On voit sur cette image prise au microscope électronique, les petites sphères de fullerènes alignées dans un nanotube: des "peapods" ou cosses de petits-pois. Le diamètre de ces tubes est de moins de 5 nanomètres (milliardièmes de mètres) |