Il parait que saler de l'eau la refroidit... C'est vrai ça?...
Je l'ai vu sur le net: il parait même que c'était un truc de cuisinier pour faire des glaces, on met du sel dans l'eau et sa température baisse.
Hem... Vous avez déjà essayé?... Le résultat est loin d'être spectaculaire. Tout dépend de la quantité de sel et d'eau dont vous diposez: avec beaucoup de sel et pas trop d'eau, à condition d'avoir un thermomètre bien sensible, peut-être distinguerez-vous une faible baisse, mais rien de bien transcendant, quelques 1/2 degrés au mieux, et encore...
Il est fort possible que les gens confondent avec un phénomène très marqué celui-là, qui consiste à mettre du sel dans la glace afin de faire un mélange réfrigérant. Là, en effet, la température baisse violemment. C'est curieusement utilisé pour faire fondre la glace d'ailleurs...
Mais ne balayons pas notre histoire de sel et d'eau d'un geste négligent... Il y a une baisse de température, faible, d'accord, mais c'est étrange tout de même. Bon, bien sûr, il ne faut pas que le sel sorte du congélateur avant d'être plongé dans de l'eau tiède, restons sérieux...
D'ailleurs, si vous avez accès à un labo de chimie et que vous mettiez la main sur du nitrate de d'ammonium ou du chlorure d'ammonium, la baisse de température lors de la dissolution sera beaucoup plus sensible: on sent nettement le récipient se rafraîchir dans notre main! Et, tout aussi étonnant, certains solides provoqueront une augmentation de température du liquide, parfois même très violente s'il s'agit d'hydroxyde de sodium (la soude servant de déboucheur d'évier), il faut donc y aller très prudemment avec lui...
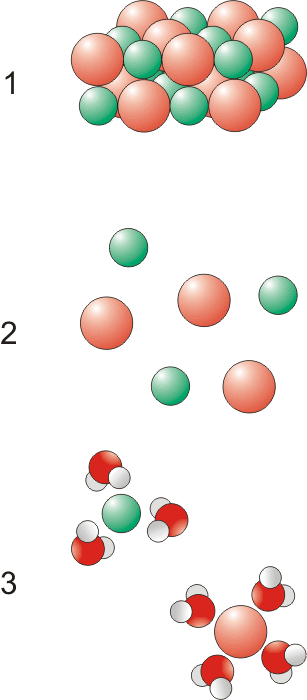
Essayons de voir de plus près ce qui arrive à ces solides:
 |
Au départ: Un cristal de "solide ionique", constitué par des ions accrochés entre eux par des liens électrostatiques. Il est encore intact, loin de l'eau... |
| Etape 1: Le cristal tombe dans l'eau et commence à se dissoudre. Pour nous, à l'oeil nu, il semble "disparaître" dans l'eau. En fait, le cristal est en cours de destruction: les ions sont séparés les uns des autres par le solvant. Ils partent vivre leur vie dans le liquide, chacun de leur côté. Bien sûr, ils sont trop petits pour être visibles individuellement. | |
| Etape 2: L'eau n'a pas été représentée sur le schéma précédent, mais c'est bien sûr elle qui casse le cristal. Son rôle n'est pas fini, car, on s'en souvient peut-être, la molécule d'eau est polarisée. Ainsi, elle ira s'associer aux ions positifs par son côté Oxygène, et aux ions négatifs par son côté Hydrogène. Cela s'appelle l'hydratation. |
Tout ça est terriblement interessant (n'est-il pas?...), mais quel rapport avec de l'eau qui se réchauffe ou se refroidit quand notre solide se dissout? Je vous le demande.
Encore une histoire d'énergies: pour réchauffer un objet (augmenter sa température) il faut lui fournir de l'énergie, pour le refroidir, il faut lui en voler. La première étape consiste en la destruction du cristal. Pour cela, pas le choix, l'eau doit fournir de l'énergie au solide pour séparer les ions. Comme l'eau perd de l'énergie, elle se refroidit. Si cette étape était toute seule, toutes les dissolutions donneraient des baisses de températures. Ce n'est pas le cas, donc, la deuxième étape, qui stabilise les ions, et les empêche de se réassocier libère de l'énergie, ce qui conduirait alors à un réchauffement. Comme ces deux étapes se déroulent quasiment en simultanné, celle qui sera prépondérante en terme d'énergie échangée conditionnera la perception globale que l'on en aura: parfois des réchauffements et parfois des refroidissements. Ce qui pourrait se traduire par ce genre de diagrammes:
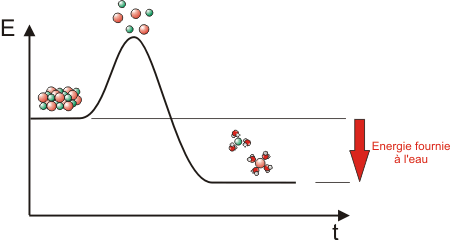 |
L'eau fournit de l'énergie au cristal, qui se trouve séparé en ses constituants élémentaires. Mais l'hydratation (supposons quelle se produise un peu après) libère de l'énergie. Si à la fin, on est en-dessous de l'état de départ, globalement de l'énergie a été libérée, l'eau s'est réchauffée. C'est une transformation exothermique. |
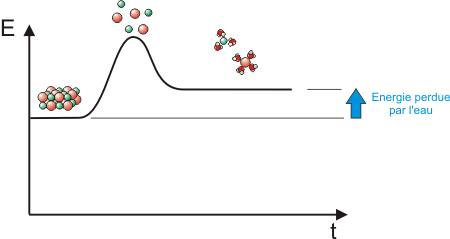 |
Cette fois, la phase d'hydration libère moins d'énergie que n'en a consommée la phase de destruction du cristal. A la fin, l'eau est plus froide, la transformation est endothermique. |
Je vous laisse imaginer à quoi ressemblerait un diagramme montrant se qui se passerait pour une dissolution sans échange global de chaleur (comme pour le sel de cuisine, dont la dissolution est quasiment athermique): l'état final et l'état initial seraient presque au même niveau, autant d'energie consommée par la première phase que d'énergie produite par la seconde. Les solides ioniques se comportant de cette façon sont souvent déjà partiellement hydratés: leurs cristaux contiennent déjà de l'eau avant même leur mise en solution. D'ailleurs si vous faites chauffer du sel tout seul dans une casserole, vous l'entendrez crépiter: ces bruits proviennent des fractures des cristaux produites par les évasions des molécules d'eau déchainées.
Il existe une application alimentaire de réchauffements lors de mises en solutions qui me fascine beaucoup: les boites de conserve auto-chauffantes: quand on ouvre la boite, de la chaux-vive contenue dans une double paroi est mise en contact avec de l'eau: la réaction est très exothermique, ce qui réchauffe le contenu...
Notre monde est merveilleux.